薬学生
薬学生酸性度の強さが覚えられない…
・暗記が苦手で中々覚えられない
・酸性度の強さのゴロを知りたい
この記事はこういった悩みをもった薬学生向けです。



こんにちは。薬剤師のあおい(@yaku_medical)です!
この記事では酸性度の強さのゴロを紹介します!
私が当時実際に使っていたものを厳選してご紹介していきます!
私がおすすめする勉強方法はこちらでご紹介していますので、参考にしてみてください♪
あわせて読みたい




【最終模試上位3%以内だった薬剤師が教える】薬剤師国家試験おすすめの勉強法とは?
科目が多すぎて何から手をつけたらいいかわからない… ・薬剤師国家試験に向けて勉強のやり方に不安がある。・おすすめの勉強法が知りたい! この記事はこんな悩みを持…
この記事の内容
- 酸性度とは?
- 酸性度の強さのゴロ
- 関連問題
目次
【ゴロで覚える薬学】酸性度の強さの覚え方教えます!
🧪 酸性度の強さ、丸暗記から卒業!
化学の構造問題や薬理の動態で、こんな悩みはありませんか?
😵
「酸性が一番強いのはどれ?」でいつも迷う
🧬
電子求引性基がつくと、なぜ酸性が強くなるの?
酸性度は、ただの暗記科目ではありません。「電子の動き」さえ理解すれば、初見の構造式でも正解を導き出せます!
酸性度とは?
共役塩基が安定になる場合(負電荷が分散しやすくなる)
H+をだしやすい場合(同周期,混成軌道)



元気いい生徒、ほんとに来るよ合格通知♪
酸性度の強さのゴロ



ムキムキ カルタ フェチミア♪
⚠️ 試験に出る!酸性度の強さランキング
以下の順序は、構造問題の正誤判定で頻出です!
スルホン酸 > カルボン酸 > フェノール > アルコール
💡 理由: 共役塩基の負電荷が、酸素原子の数や芳香環への共鳴によってどれだけ分散(安定化)できるかで決まります。
関連問題
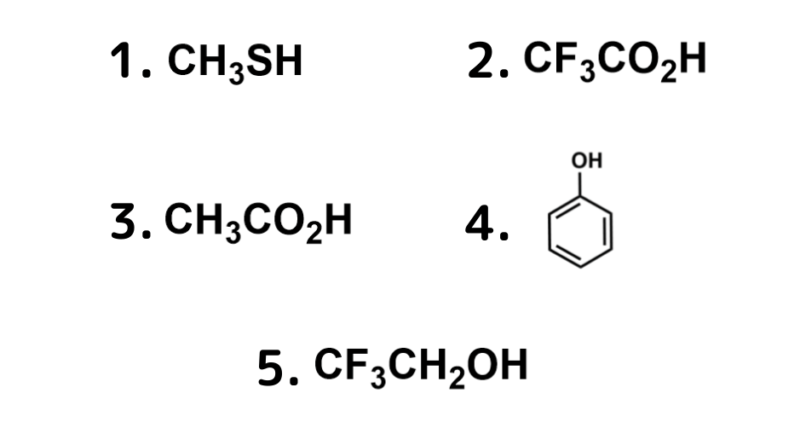
📝 実戦問題(第101回 問10)
以下の化合物の中で、最も酸性度が高いのはどれか。1つ選べ。

▼ タップして正解を見る
正解:
2
💡 ここをチェック!
- ① まず「ムキムキカルタ…」のゴロで絞り込み!カルボキシル基を持つ2と3が、1(フェノール)や4, 5(アルコール)より酸性が強いことがわかります。
- ② 次に「電子求引性基」に注目。2には最強の電子求引性基であるフッ素(F)が3つも結合しています!
- ➔ Fが電子を強く引っ張ることで、H+を放出した後の負電荷が分散し、共役塩基が非常に安定化します。よって2が最強の酸となります。
最後に
今回は、薬剤師国家試験対策として化学の範囲で使える酸性度の強さのゴロをご紹介しました。
ゴロで覚える薬学シリーズでは、使いやすいゴロや覚え方をご紹介しています。



薬剤師国家試験に向けて他のゴロが知りたい方はこちらで紹介しています♪